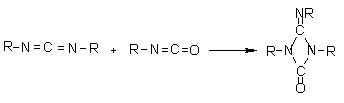1.2 - ISOCIANATOS
Os
isocianatos possuem o grupo NCO que reage com compostos que possuam átomos
de hidrogênio ativo (Tabela 1.3), como os polióis, a água,
os extensores de cadeia, etc. Todos os isocianatos usados comercialmente (Tabela
1.2)
possuem
no mínimo dois grupos funcionais. Deles, mais de 95% são aromáticos
à base do TDI
(31%) (Capítulo 1)
e dos diferentes tipos de MDI
(66%) (Capítulo 1).
Como os PUs produzidos com isocianatos aromáticos mostram tendência ao amarelecimento
sem perda das propriedades mecânicas, quando a manutenção da cor é um fator
preponderante devem ser utilizados os isocianatos
alifáticos (Capítulo
1), como o hexametileno diisocianato (HDI), o isoforona diisocianato (IPDI),
o diciclohexilmetano diisocianato (HMDI), normalmente usados na forma de isocianatos
modificados (Capítulo
1). Temos ainda
os isocianatos
especiais como: 1,5-naftaleno diisocianato (NDI) usado em elastômeros sólidos
e microcelulares de alto desempenho; bitolileno diisocianto (TODI) usado em
TPU's com propriedades superiores em altas temperaturas; e p-fenileno diisocianto
(PPDI) usado PUs com propriedades dinâmicas e termomecânicas superiores.
Tabela 1.2 - Isocianatos Comerciais
|
Nome Comercial / Científico
|
Fórmula
|
Estrutura
|
Peso Molecular
|
Funcionalidade
|
Peso Equivalente
|
Teor de NCO (%)
|
Temperatura de Fusão (°C)
|
Temperatura de Ebulição
(°C)
|
Densidade
|
Toxidade
|
|
2,4-tolueno
diisocianato (TDI)/ 2,4-diisocianato de 1-metil-benzeno
|
C9H6O2N2
|
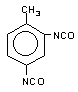
|
174,2
|
2
|
87,08
|
48,2
|
21,8
|
121 (10 mm Hg)
|
1,061 (20°C)
|
Tóxico
|
|
2,6-tolueno
diisocianato (TDI) / 2,6-diisocianato de 1-metil-benzeno
|
C9H6O2N2
|
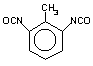
|
174,2
|
2
|
87,08
|
48,2
|
18,2
|
120 (10 mm Hg)
|
1,2271 (20°C)
|
Tóxico
|
|
Tolueno diisocianato
mistura 2,4:2,6=65:35 (TDI-65/35)
|
C9H6O2N2
|
|
174,2
|
2
|
87,08
|
48,2
|
5,0
|
121 (10 mm Hg)
|
1,222 (20°C)
|
Tóxico
|
|
Tolueno diisocianato
mistura 2,4:2,6=80:20 (TDI-80/20)
|
C9H6O2N2
|
|
174,2
|
2
|
87,08
|
48,2
|
13,6
|
121 (10 mm Hg)
|
1,221 (20°C)
|
Tóxico
|
|
4,4’-difenil
metano diisocianato (MDI)/1,1’-metileno bis (4-isocianato benzeno)
|
C15H10O2N2
|
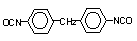
|
250,3
|
2
|
125,13
|
33,6
|
39,5
|
208 (10 mm Hg)
|
1,183 (50°C)
|
Nocivo à saúde
|
|
2,4’-difenil
metano diisocianato (MDI)/ 1-isocianato-2-(4-isocianato fenil) metilbenzeno
|
C15H10O2N2
|
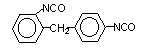
|
250,3
|
2
|
125,13
|
33,6
|
34,5
|
154 (1,3 mm Hg)
|
1,192 (40°C)
|
Nocivo à saúde
|
|
2,2’-difenil
metano diisocianato (MDI)/1,1’-metileno bis (2-isocianato benzeno)
|
C15H10O2N2
|
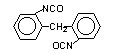
|
250,3
|
2
|
125,13
|
33,6
|
46,5
|
145 (1,3 mm Hg)
|
1,188 (50°C)
|
Nocivo à saúde
|
|
Hexametileno
diisocianato (HDI)/1,6-diisocianato hexano
|
C8H12O2N2
|
OCN-(CH2)6-NCO
|
168,2
|
2
|
84,1
|
49,9
|
-67
|
127 (10 mm Hg)
|
1,047 (20°C)
|
Tóxico
|
|
Isoforona diisocianato
(IPDI)/5-isocianato-1-(metilisocianato)-1,3,3’- trimetil ciclohexano
|
C12H18O2N2
|
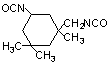
|
222,3
|
2
|
111,15
|
37,8
|
-60
|
158 (10 mm Hg)
|
1,061 (20°C)
|
Tóxico
|
|
Meta-tetrametilxileno
diisocianato (TMXDI) / bis (isocianato-1-metil- 1-etil)-1,3-benzeno
|
C14H16N2O2
|
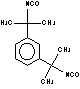
|
244,3
|
2
|
122,13
|
34,4
|
-
|
150 (50 mm Hg)
|
1,05 (20°C)
|
Nocivo à saúde
|
|
4,4’-diciclohexilmetano
diisocianato (HMDI)/1,1’-metileno-bis(4-isocianato ciclohexano)
|
C15H22O2N2
|
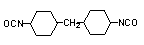
|
262,3
|
2
|
131,18
|
32,0
|
19-23
|
179 (10 mm Hg)
|
-
|
Tóxico
|
| Trifenilmetano-4,4’,4”-triisocianato/1,1’,1”-metilenotris
(4 isocianato benzeno) |
C22H13O3N3
|
|
367,4
|
3
|
183,7
|
22,86
|
91
|
-
|
-
|
Nocivo à saúde
|
|
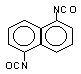
Naftaleno 1,5-diisocianato
(NDI)/1,5 diisocianato naftaleno
|
C12H6O2N2
|
|
210,2
|
2
|
105,10
|
40,0
|
127
|
183 (10 mm Hg)
|
1,450 (20°C)
|
Nocivo à saúde
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.2.1
- Reações dos isocianatos
A
manufatura dos PUs começou como uma peça empírica dos químicos, porém os pioneiros
neste campo trataram de desvendar os segredos científicos desta área de pesquisa,
e muitas descobertas foram realizadas desde o trabalho original de Otto Bayer.
Todavia ainda encontramos evidências de caráter empírico nos fundamentos da
química dos PUs. A observação da estrutura eletrônica do grupo isocianato indica
que são possíveis as estruturas de ressonância da Figura 1.5. A densidade de
elétrons é menor no átomo de carbono, intermediária no nitrogênio e maior no
oxigênio. Nos PUs a maioria das reações dos isocianatos ocorre através da adição
à dupla ligação C=N. Um centro nucleofílico contendo um átomo de hidrogênio
ativo ataca o carbono eletrofílico e o átomo de hidrogênio ativo é então adicionado
ao nitrogênio. Grupos aceptores de elétrons, ligados ao grupamento NCO, aumentam
sua reatividade e os doadores a reduzem, e por isso, os isocianatos aromáticos
são mais reativos do que os alifáticos. A ocorrência de impedimento estérico
tanto no grupo isocianato, quanto no composto com hidrogênio ativo provocam
diminuição na reatividade.
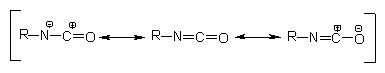
Figura 1.5 - Estruturas de ressonância do
grupamento isocianato.
Na tecnologia dos PUs
existem cinco reações principais dos isocianatos com: (1) polióis formando poliuretanos;
(2) aminas dando poliuréias; (3) água originando poliuréia e liberando gás carbônico
que é o principal agente de expansão nas espumas de PU; (4) grupos uretano
e (5) uréia resultando na formação de ligações cruzadas alofanato e biureto,
respectivamente (Figura 1.6).

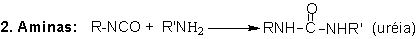
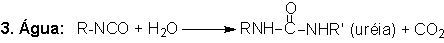
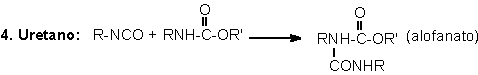
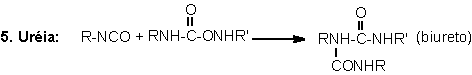
Figura 1.6 - Principais reações dos isocianatos.
1.2.1.1 - Reações com álcoois -
A reação de polimerização (1), entre um álcool e um isocianato formando o PU
é exotérmica e libera cerca de 24 kcal/mol de uretano formado. A reação dos
isocianatos com álcoois é uma reação de velocidade moderada (Tabela 2.2), sendo
normalmente catalisada por bases, principalmente as aminas terciárias e organometais.
A estrutura dos compostos influencia a reatividade e as hidroxilas primárias,
secundárias e terciárias têm reatividade decrescente devido ao efeito estérico
dos grupos vizinhos. A basicidade das aminas exerce forte efeito catalítico
nas reações dos isocianatos, portanto, os compostos hidroxilados usados como
extensores de cadeia ou formadores de ligações cruzadas, que contenham grupamentos
amino terciários como a trietanol amina apresentam efeito catalítico.
1.2.1.2 - Reações com aminas - A
reação (2) dos isocianatos com aminas, formando poliuréias, é
muito rápida (Tabela 1.3) e não necessita de catálise. Aminas alifáticas reagem
mais rapidamente do que as aminas aromáticas de menor basicidade, desde que
não haja impedimento estérico muito significativo. As aminas aromáticas serão
tão menos reativas quanto maior a eletronegatividade dos substituintes do anel
aromático. Em adição aos efeitos eletrônicos que influenciam a basicidade do
nitrogênio amínico, o efeito estérico é um fator importante. Os substituintes
na posição orto, da mesma forma que no caso dos isocianatos retardam
fortemente a velocidade de reação. As aminas alifáticas que são muito reativas
têm emprego como extensores de cadeia, em processos em uma etapa, na tecnologia
de poliuréia por moldagem por injeção e reação (RIM) (Capítulo
4) e revestimentos aplicados por RIM-Spray (Capítulo
7). Por outro lado, as aminas aromáticas bem menos reativas, como a metilenobis-o-cloroanilina
(MOCA), são empregadas como extensores de cadeia nos processos de obtenção de
elastômeros de PU moldados por vazamento (Capítulo
6).
1.2.1.3 - Reação com a água -
A
reação de expansão (3), dos isocianatos com água resulta na formação de uréia
e gás carbônico. Esta reação é de extrema importância na fabricação das espumas
de PU, onde a difusão do gás carbônico para as bolhas de ar previamente nucleadas
causa a expansão da espuma. A reação é bastante exotérmica e desprende cerca
de 47 kcal/mol de água. A velocidade da reação do isocianato com a água é comparável
à velocidade da reação do isocianato com álcool primário, porém muito menor
que a velocidade da reação do isocianato com amina (Tabela
1.3). A reação de isocianatos com água é catalisada por aminas terciárias e
ocorre em duas etapas. Inicialmente é formado o ácido carbâmico que se decompõe
em gás carbônico e na amina correspondente. Esta reage imediatamente com o diisocianato,
formando uréia (Figura 1.7).
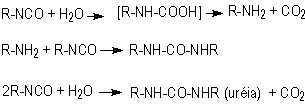
Figura 1.7 - Reação do grupamento isocianato
com água.
1.2.1.4 - Reações com uréias e
uretanos - Os hidrogênios dos grupos uretano e uréia também
podem reagir com o NCO formando respectivamente ligações cruzadas alofanato
e biureto. Estas reações são reversíveis e ocorrem em temperaturas superiores
a 110°C,
podendo ser classificadas como lenta e muito lenta, respectivamente (Tabela
1.3), quando não catalisadas. Elas ocorrem principalmente na pós-cura dos PUs,
onde estes permanecem por longo tempo em temperaturas elevadas, como por exemplo:
22 horas a 70°C,
ou dias à temperatura ambiente, dependendo do sistema empregado.
1.2.1.5 - Reações com ácidos -
Além das cinco reações principais descritas, também ocorrem reações dos isocianatos
com ácidos (Figura 1.8), sendo que no caso dos ácidos carboxílicos ocorre liberação
de gás carbônico.
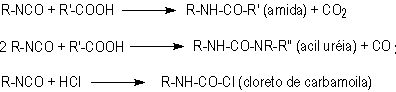
Figura 1.8 - Reação do grupamento isocianato com ácidos
1.2.1.6 - Reações
de condensação - Os isocianatos também
podem reagir entre si formando dímeros, trímeros (isocianuratos), polímeros,
carbodiimidas e uretanoiminas (Figura 1.9). A dimerização do isocianato para
formar uretidinadionas deve ser conduzida em temperaturas baixas devido à sua
instabilidade térmica, o que explica porque a dimerização dos isocianatos é
limitada aos mais reativos, como os isocianatos aromáticos. A trimerização dos
isocianatos é de grande importância comercial, principalmente a do MDI para
formar poliisocianuratos muito utilizados nas espumas rígidas (Capítulo
5). A formação das carbodiimidas e a subseqüente reação com o excesso de
isocianato para formar uretanoiminas são também de grande importância técnica
na modificação do 4,4`-difenilmetano diisocianato (MDI) puro, para formar uma
mistura líquida com ponto de fusão inferior a 20°C (Capítulo
1).
Dimerização
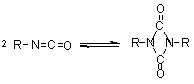 (uretidinadiona) (uretidinadiona)
|
|
Trimerização
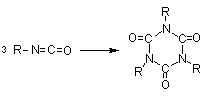 (isocianurato) (isocianurato)
|
|
Formação
de carbodiimida
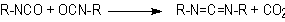
|
|
Formação
de uretanoimida
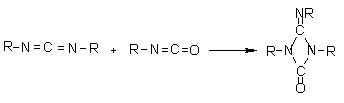
|
Figura 1.9 - Reações de condensação dos isocianatos
1.2.2 - Reatividade
A
estrutura do isocianato tem importância na reatividade do grupo NCO, que é aumentada
por substituintes que elevem a carga positiva no carbono. Assim, isocianatos
alifáticos são menos reativos que os aromáticos, os quais serão mais reativos
quanto maior a eletronegatividade dos substituintes do anel aromático. Em adição,
ao efeito eletrônico, os fatores estéricos são também importantes. Substituintes
volumosos próximos ao sítio de reação diminuem a velocidade de reação. Estes
fatores estéricos também influenciam a especificidade dos catalisadores, visto
que eles igualmente, necessitam se aproximar do sítio da reação, para exercer
seu efeito catalítico. Os grupos NCO reagem com velocidades diferentes com os
diversos compostos contendo átomos de hidrogênio ativo e as velocidades relativas
das principais reações dos isocianatos são mostradas na Tabela 1.3.
Tabela
1.3- Velocidade relativa de reações típicas
dos isocianatos
|
Composto com hidrogênio ativo
|
Estrutura Típica
|
Velocidade Relativa*
|
|
Amina
alifática primária
|
R-NH2
|
100.000
|
|
Amina
alifática secundária
|
RR’NH
|
20.000 – 50.000
|
|
Amina
aromática primária
|
Ar-NH2
|
200 – 300
|
|
Hidroxila
primária
|
RCH2-OH
|
100
|
|
Água
|
HOH
|
100
|
|
Ácido
carboxílico
|
RCOOH
|
40
|
|
Hidroxila
secundária
|
RR’CH-OH
|
30
|
|
Uréia
|
R-NH-CO-NH-R
|
15
|
|
Hidroxila
terciária
|
RR’R”C-OH
|
0,5
|
|
Uretano
|
R-NH-CO-O-R
|
0,3
|
|
Amida
|
RCO-NH2
|
0,1
|
*
da reação não catalisada a 25oC
Reatividade dos isocianatos comerciais
- A
seguir são mostradas as reatividades dos diferentes grupos NCO dos principais
isocianatos comerciais:
TDI
- No 2,4-TDI o grupo 4-NCO possuiu reatividade em média aproximadamente
quatro vezes maior do que a do 2-NCO e é 50% mais reativo do que o 4-NCO
do MDI. Nos
diisocianatos que contém ambos os grupos NCO no mesmo anel aromático a reatividade
é dependente do efeito ativador do outro grupo substituinte. O decréscimo
da reatividade é maior se um outro substituinte estiver presente em posição
orto em relação ao segundo NCO. Tão logo o primeiro NCO reaja, por exemplo,
com um álcool, o grupo NCO remanescente passa a ter a reatividade de um monoisocianato
com um substituinte uretano, e o grupo uretano tem efeito ativador bem menor
do que o grupo NCO na mesma posição. No
TDI o grupo NCO na posição para reage muito mais rapidamente do que o
NCO em posição orto. Na temperatura ambiente, se considerarmos como 100
a reatividade do grupo NCO na posição para do 2,4-TDI, a do grupo NCO
em orto seria 12. No 2,6-TDI a do primeiro grupo NCO a reagir seria 56
e a do segundo cairia para 17. Todavia, quando a temperatura se aproxima de
100oC, os efeitos estéricos são sobrepujados e ambas as posições
têm reatividades próximas. Algumas propriedades físicas das espumas sofrem a
influência da relação entre os isômeros do TDI utilizados, devido a esta diferença
de reatividades. Nos diisocianatos em que os dois grupos NCO estão em anéis
aromáticos diferentes, como no caso do MDI, ou são separados por cadeias alifáticas
o efeito dos grupos NCO ou uretanos, no segundo grupo isocianato, não é importante.
MDI - O
4,4'-MDI puro é uma molécula simétrica possuindo grupos
NCO com reatividades iguais. O isômero 2,4'-MDI é assimétrico,
sendo o grupo 4'-NCO aproximadamente 4 vezes mais reativo do que o 2-NCO. O
MDI polimérico é uma molécula complexa que contém
as estruturas 4,4' e 2,4', além de espécies tri, tetra e polifuncionais.
No MDI polimérico os grupos NCO apresentam três reatividades diferentes:
o 4-NCO na extremidade da cadeia tem reatividade equivalente a do 4,4'-MDI;
o 2-NCO na extremidade da cadeia possui reatividade de 25% da do 4,4'-MDI, enquanto
os grupos 2-NCO no meio da cadeia possuem de 15 a 20%.
NDI -
O 1,5-NDI é uma molécula rígida e simétrica com
os dois grupos NCO de igual reatividade e similar a do 4-NCO do MDI.
HDI -
O 1,6-HDI é uma molécula flexível, linear e simétrica
com dois grupos NCO alifáticos primários, de igual reatividade,
e com cerca da metade da reatividade do 4-NCO do MDI.
IPDI -
O IPDI (5-isocianato-1-(metilisocianato)-1,3,3'- trimetil ciclohexano) é uma
molécula assimétrica, cicloalifática, comercializado na forma de mistura de
isômeros (25/75 cis/trans). Devido a este fato possui quatro grupos NCO diferentes.
Dois são grupos NCO alifáticos e secundários, com reatividade de aproximadamente
metade da do NCO do HDI. Os outros dois grupos NCO são primários, porém estericamente
impedidos e com velocidade cinco vezes menor do que do MDI, o que torna o IPDI
o menos reativo dos isocianatos comerciais.
HMDI -
O HMDI é comercializado como mistura 90 / 10 dos isômeros 4,4'
/ 2,4'. O 4,4'-diisocianatociclohexilmetano consiste de três isômeros
conformacionais, cis-cis, cis-trans e trans-trans. Os grupos NCO são
secundários e possuem reatividade similar a dos grupos NCO secundários
do IPDI.
1.2.3 - Isocianatos comerciais


![]()




![]()


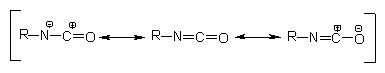
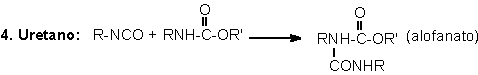
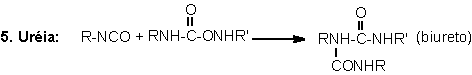
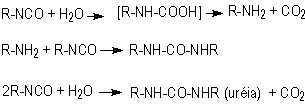
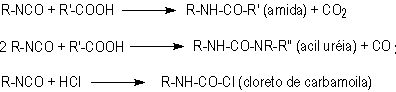
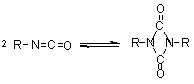 (uretidinadiona)
(uretidinadiona)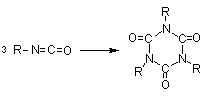 (isocianurato)
(isocianurato)